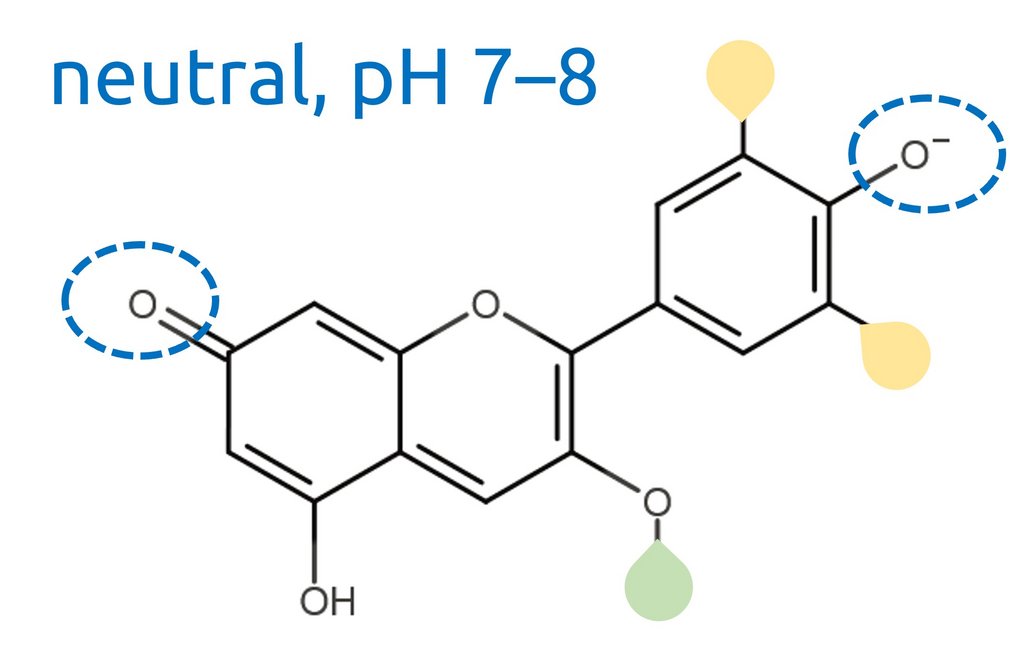
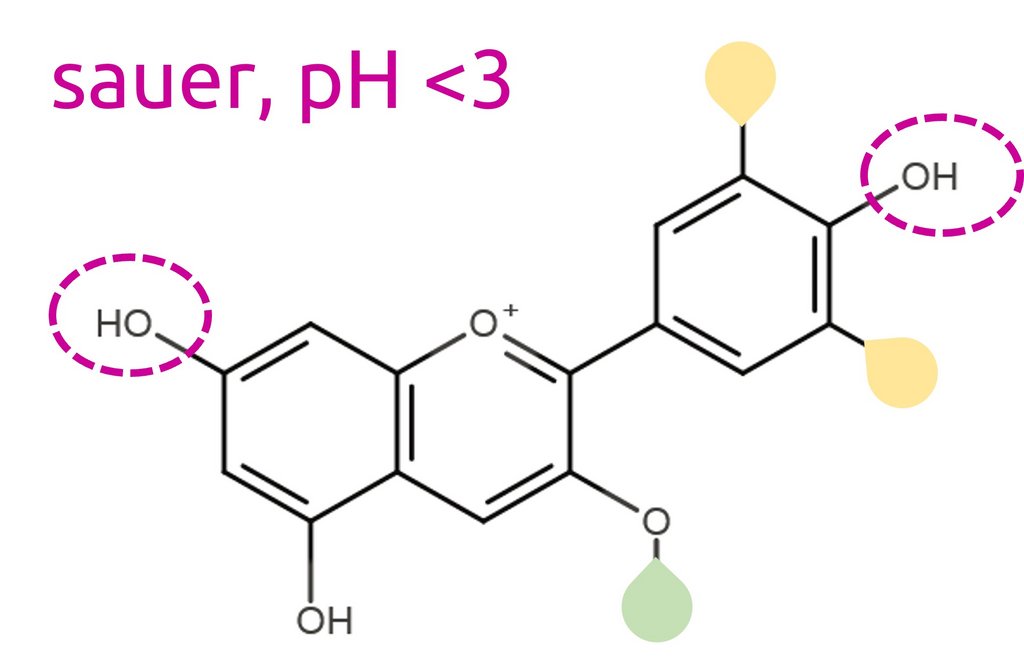
Der pH-Wert gibt an, wie sauer oder basisch eine Flüssigkeit ist. Kurz gesagt ist er ein Mass für die Anzahl „Säureteilchen“ im Wasser. Man kann den pH-Wert mit Messgeräten genau bestimmen, aber für manche Anwendungen (z. B. Schnelltests in der Umwelt oder in einer Arztpraxis) nutzt man auch Papierstreifen mit einer Beschichtung, die je nach pH-Wert die Farbe ändert. Solche Farbstoffe nennt man pH-Indikatoren.
In der Natur kommen ebenfalls pH-Indikatoren vor, zum Beispiel eine Gruppe von blau-violetten Pflanzenfarbstoffen, die man Anthocyane nennt. Am Beispiel der Anthocyane lässt sich gut zeigen, warum pH-Indikatoren mit einer Farbveränderung auf Säure reagieren.