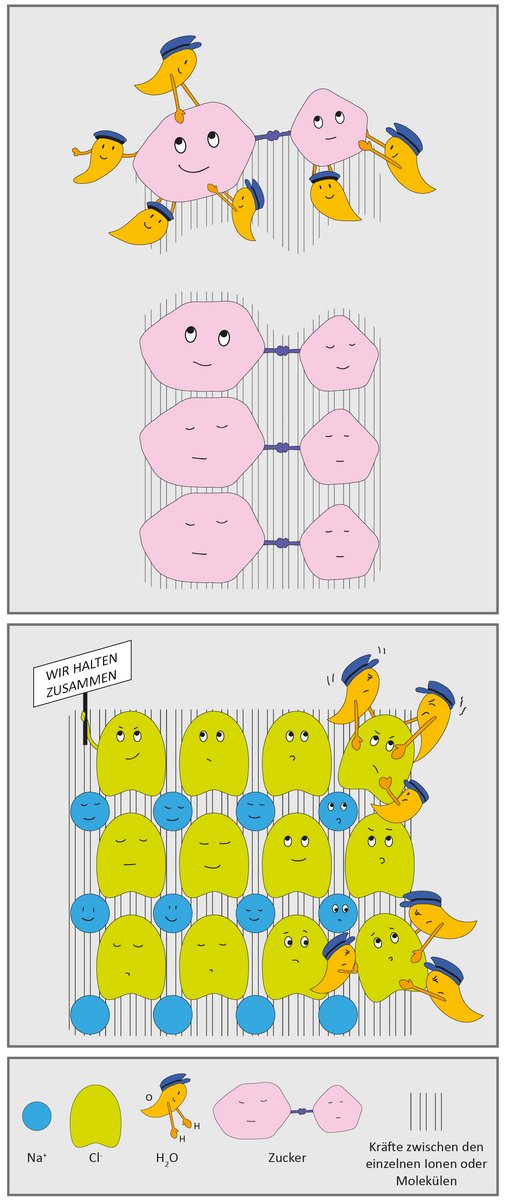
Das Lösen von Zucker in Wasser könnte man mit dem Zerstreuen einer Demonstration durch die Polizei vergleichen: Die Zuckermoleküle wollen wir uns dabei als Demonstranten, die Wassermoleküle als Polizisten vorstellen. Zuerst sind die beiden Gruppen von Demonstranten und Polizisten getrennt, doch wenn der Zucker ins Wasser hinzugefügt wird, treffen sie aufeinander. Nun versuchen jeweils mehrere Polizisten einen Demonstranten in die Mitte zu nehmen und ihn aus der Demonstrantengruppe zu lösen. Am Schluss ist jeder Demonstrant, also jedes Zuckermolekül, von mehreren Wassermolekülen umringt: Man erhält eine Zuckerlösung. Die einzelnen Zuckermoleküle sind so klein, dass man sie nicht mehr von Auge als Zucker erkennen kann.
Wasser bildet mit gewissen Stoffen "Wasserstoffbrücken"
Der beschriebene Vorgang findet statt, weil die Wassermoleküle sogenannte „Wasserstoffbrücken“ mit den Zuckermolekülen bilden, wenn sie sich um sie herum anordnen. Die Brückenbildung beruht darauf, dass sich die Elektronen der Sauerstoffatome und der Kern (also das Proton) von Wasserstoffatomen anziehen. Im Zucker gibt es viele Sauerstoff- und Wasserstoffatome, und Wasser besteht sogar ausschliesslich daraus.
Wenn Salze wie z. B. Kochsalz aufgelöst werden, passiert etwas ganz Ähnliches. In Salzen sind die Ionen (negativ bzw. positiv geladene Atome) in einer charakteristischen geometrischen Struktur angeordnet, die stabil ist, da sich die Ionen in einem günstigen Energiezustand befinden. Man könnte sagen, sie "fühlen sich wohl" in dieser Struktur. Wenn das Salz gelöst wird, versuchen die Wassermoleküle wie beim Zucker, einzelne Teilchen aus der Struktur herauszulösen und zu umringen. Je nachdem, wie stark das Salzgitter ist und wie "glücklich" die Ionen darin sind, gelingt dies mehr oder weniger leicht. Kalk, ein Calciumsalz, hat eine starke Gitterstruktur, weshalb es schlecht löslich ist und darum den Wasserhahn verstopft. Kochsalz lässt sich viel besser lösen.
Lässt sich mehr Zucker oder mehr Kochsalz in Wasser lösen?
Von den meisten Stoffen ist die Löslichkeit in Wasser bekannt. Bei Kochsalz liegt diese bei 359 Gramm pro Liter (bei 20°C). Kristallzucker (Saccharose) löst sich mit 1970 Gramm pro Liter (bei 20°C) äusserst gut in Wasser. Bei 90°C lösen sich sogar über 4 kg Kristallzucker.
Welche Rolle spielt die Temperatur?
Einerseits sind Moleküle bei höherer Temperatur aktiver und bewegen sich schneller. Darum geht der Vorgang des Lösens schneller vor sich. Andererseits lässt sich bei höherer Temperatur häufig mehr von dem Feststoff in der Flüssigkeit lösen, seine Löslichkeit steigt also. Dies ist jedoch von den verwendeten Stoffen abhängig. Warum ist das so? Beim Lösen wird die ursprüngliche Struktur des Feststoffs aufgebrochen, und die Moleküle gruppieren sich neu. Dabei verändert sich ihr Energiezustand: Es wird entweder etwas Energie in Form von Wärme frei, oder Wärme wird aufgenommen. Entsprechend verläuft der Lösungsvorgang entweder exotherm (es entsteht Wärme) oder endotherm (der Vorgang benötigt Wärme). Wenn dem System aus Feststoff und Flüssigkeit Wärme von aussen zugeführt wird, beschleunigt dies endotherme Reaktionen. Exotherme Reaktionen hingegen laufen nicht mehr ab, da das System im Gleichgewicht bleiben und nicht noch mehr heizen, sondern die Wärmezufuhr durch Abkühlung ausgleichen will. Kochsalz löst sich mit einer sehr schwachen endothermen Reaktion, weshalb bei einer höheren Temperatur nicht viel mehr als bei einer tieferen Temperatur gelöst werden kann.