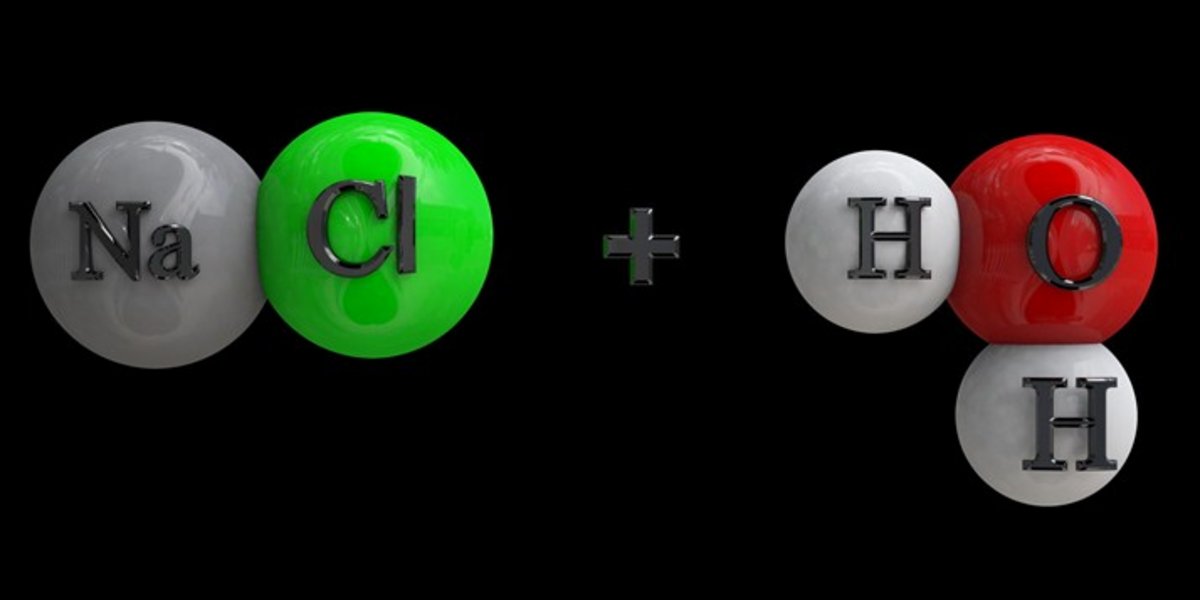Dans la nature, on ne trouve pas de chlore sous une forme pure mais de grandes quantités sont fabriquées par des procédés industriels. On l’obtient par exemple à partir d’eau salée par électrolyse. Dans ce procédé, on utilise un courant électrique pour déclencher une réaction dite d’oxydo-reduction; dans la solution le courant induit un transfert d'électrons entre les ions en présence et de nouvelles molécules se créent.
Voici les composés chimiques qui entrent en jeu lors de l’électrolyse de l’eau salée:
- De l’eau: H2O
- Du sel de cuisine (chlorure de sodium): NaCl
- De l’hydrogène (gazeux): H2
- Du chlore (gazeux): Cl2
- De l’hydroxyde de sodium (ou de la soude caustique): NaOH
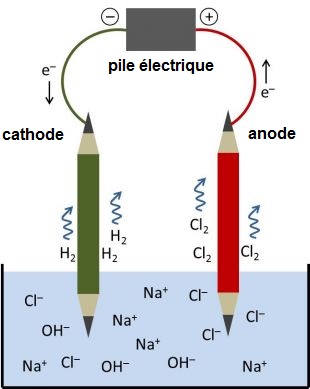
Quand le sel se dissout dans l'eau, les particules de chlore et de sodium se séparent en ions de chlore (Cl-) chargés négativement et en ions de sodium (Na+) chargés positivement. Lorsqu’on branche les deux pôles de la pile à deux crayons plongés dans l’eau, ces derniers font office d’électrodes car les mines en graphite conduisent l’électricité. Dans l’eau les ions H+ qui acceptent des électrons, vont s’accumuler sur un des crayons, la cathode, liée au pôle négatif de la pile, et former de l’hydrogène H2. En même temps, les ions de chlore qui s’accumulent sur l’autre électrode, l’anode, liée au pôle positif de la pile, cèdent leurs électrons et forment du chlore gazeux. Le circuit électrique est ainsi «fermé» et le courant peut circuler. Les ions sodium (Na+) et OH- vont se concentrer et s’associer dans la solution qui, d’eau salée, se transformera petit à petit en solution de soude caustique diluée.
La réaction d’électrolyse est la suivante:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Texte: Rédaction SimplyScience.ch
Cet article a été automatiquement importé de notre ancien site. Merci de nous signaler, à redaction(at)simplyscience.ch, toute erreur d'affichage.