Stabile Isotope
Von manchen Elementen gibt es mehrere stabile Isotope, und einige dieser Isotope haben interessante Anwendungen: Mit ihrer Hilfe können Umweltprozesse, die Lebensweise von Urmenschen, Krankheiten und vieles andere aufgedeckt werden.
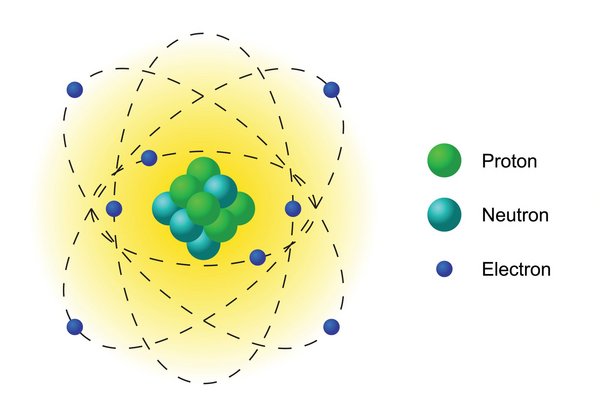
Der Aufbau der Atome
Atome, die Bausteine aller Stoffe, sind aus dem Atomkern (Nucleus) und der Atomhülle aufgebaut. In der Atomhülle befinden sich die negativ geladenen Elektronen, im Atomkern die positiv geladenen Protonen und ungeladenen Neutronen. Alle Atome desselben Elements haben dieselbe Anzahl Protonen im Kern, während die Anzahl der Neutronen variieren kann. CanStockPhoto
Der Aufbau der Atome
Atome, die Bausteine aller Stoffe, sind aus dem Atomkern (Nucleus) und der Atomhülle aufgebaut. In der Atomhülle befinden sich die negativ geladenen Elektronen, im Atomkern die positiv geladenen Protonen und ungeladenen Neutronen. Alle Atome desselben Elements haben dieselbe Anzahl Protonen im Kern, während die Anzahl der Neutronen variieren kann. CanStockPhoto
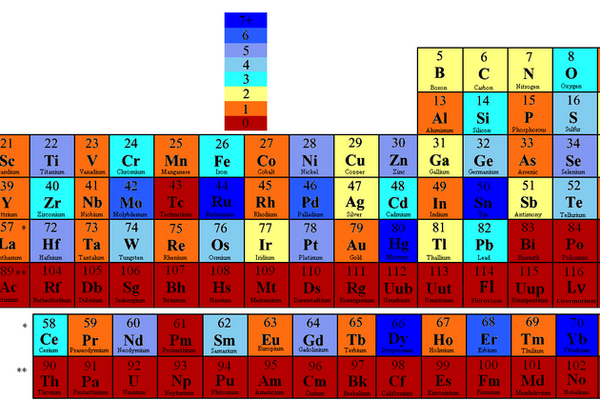
Stabile Isotope
Als Isotope bezeichnet man Atome desselben Elements (also mit derselben Anzahl Protonen), aber einer unterschiedlichen Anzahl Neutronen im Atomkern. Stabile Isotope sind, wie der Name schon sagt, stabil. Im Gegensatz dazu zerfallen radioaktive Isotope – je nach Atom schneller oder langsamer – von selbst in andere Elemente. Das abgebildete Periodensystem der Elemente zeigt, wie viele stabile Isotope jedes Element hat. Während einige Elemente kein einziges stabiles Isotop haben, das heisst auf jeden Fall radioaktiv sind, haben andere sogar mehr als sieben verschiedene stabile Isotope. Nergaal/Wikimedia Commons, CC BY-SA 3.0
Stabile Isotope
Als Isotope bezeichnet man Atome desselben Elements (also mit derselben Anzahl Protonen), aber einer unterschiedlichen Anzahl Neutronen im Atomkern. Stabile Isotope sind, wie der Name schon sagt, stabil. Im Gegensatz dazu zerfallen radioaktive Isotope – je nach Atom schneller oder langsamer – von selbst in andere Elemente. Das abgebildete Periodensystem der Elemente zeigt, wie viele stabile Isotope jedes Element hat. Während einige Elemente kein einziges stabiles Isotop haben, das heisst auf jeden Fall radioaktiv sind, haben andere sogar mehr als sieben verschiedene stabile Isotope. Nergaal/Wikimedia Commons, CC BY-SA 3.0
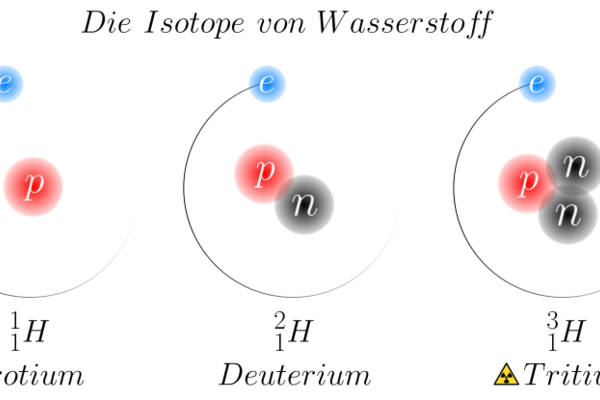
Das Beispiel der Wasserstoffisotope
Das Element Wasserstoff hat ein Proton im Atomkern. Hat es keine Neutronen, wird es als Protium oder einfach als Proton bezeichnet, oder 1H – die hochgestellte Zahl vor dem Element ist immer die Summe aus Protonen und Neutronen. 99.99% aller Wasserstoffatome haben kein Neutron. Wasserstoff mit einem Neutron (2H) wird als Deuterium bezeichnet. Dieses Isotop ist stabil und macht 0.01% des in der Umwelt vorkommenden Wasserstoffs aus. Wasserstoff mit zwei Neutronen (3H) wird Tritium genannt; es ist radioaktiv und kommt nur in Spuren auf der Erde vor. Johannes Schneider/Wikimedia Commons, CC BY-SA 4.0
Das Beispiel der Wasserstoffisotope
Das Element Wasserstoff hat ein Proton im Atomkern. Hat es keine Neutronen, wird es als Protium oder einfach als Proton bezeichnet, oder 1H – die hochgestellte Zahl vor dem Element ist immer die Summe aus Protonen und Neutronen. 99.99% aller Wasserstoffatome haben kein Neutron. Wasserstoff mit einem Neutron (2H) wird als Deuterium bezeichnet. Dieses Isotop ist stabil und macht 0.01% des in der Umwelt vorkommenden Wasserstoffs aus. Wasserstoff mit zwei Neutronen (3H) wird Tritium genannt; es ist radioaktiv und kommt nur in Spuren auf der Erde vor. Johannes Schneider/Wikimedia Commons, CC BY-SA 4.0

Wie unterscheiden sich Isotope eines Elements?
Prinzipiell haben die verschiedenen Isotope eines Elements sehr ähnliche Eigenschaften. Isotope mit mehr Neutronen haben aber eine etwas grössere Masse und verhalten sich bei bestimmten Vorgängen anders. Man nennt sie daher auch „schwere Isotope“. CanStockPhoto
Wie unterscheiden sich Isotope eines Elements?
Prinzipiell haben die verschiedenen Isotope eines Elements sehr ähnliche Eigenschaften. Isotope mit mehr Neutronen haben aber eine etwas grössere Masse und verhalten sich bei bestimmten Vorgängen anders. Man nennt sie daher auch „schwere Isotope“. CanStockPhoto

Analyse von Isotopen
Isotope werden im Labor mithilfe verschiedener Geräte analysiert, häufig mit einem Massenspektrometer. Wikimedia Commons
Analyse von Isotopen
Isotope werden im Labor mithilfe verschiedener Geräte analysiert, häufig mit einem Massenspektrometer. Wikimedia Commons
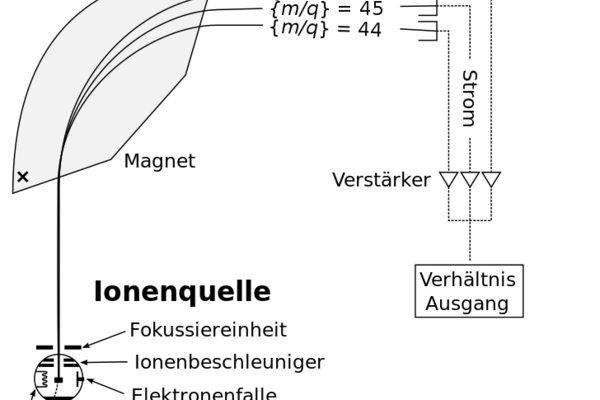
Prinzip der Isotopenanalyse
Im Massenspektrometer sorgen unter anderem ein Vakuum und ein magnetisches Feld dafür, dass die verschiedenen Isotope eines Elements sich aufgrund ihres unterschiedlichen Gewichts auftrennen und von verschiedenen Detektoren erfasst werden. Wikimedia Commons
Prinzip der Isotopenanalyse
Im Massenspektrometer sorgen unter anderem ein Vakuum und ein magnetisches Feld dafür, dass die verschiedenen Isotope eines Elements sich aufgrund ihres unterschiedlichen Gewichts auftrennen und von verschiedenen Detektoren erfasst werden. Wikimedia Commons

Leichte Isotope im Wasserdampf
Wenn wir Wasser kochen, verdampft es zu gasförmigem Wasserdampf. Auch Wasser von Seen oder Ozeanen verdunstet in die Atmosphäre. Dabei verbleiben die Wassermoleküle mit schwereren Wasserstoff- und Sauerstoffisotopen eher in der flüssigen Phase, während die leichten Isotope (bzw. die „normalen“ Wassermoleküle) rascher verdampfen. Die Isotopenverhältnisse in der Atmosphäre ändern sich also je nach Klima, da bei heissen Bedingungen insgesamt mehr Wasser verdampft. Der Zustand der Atmosphäre wiederum bildet sich über Niederschläge im Polareis ab, und deshalb können Eisbohrkerne viel über das Klima der Vergangenheit berichten. CanStockPhoto
Leichte Isotope im Wasserdampf
Wenn wir Wasser kochen, verdampft es zu gasförmigem Wasserdampf. Auch Wasser von Seen oder Ozeanen verdunstet in die Atmosphäre. Dabei verbleiben die Wassermoleküle mit schwereren Wasserstoff- und Sauerstoffisotopen eher in der flüssigen Phase, während die leichten Isotope (bzw. die „normalen“ Wassermoleküle) rascher verdampfen. Die Isotopenverhältnisse in der Atmosphäre ändern sich also je nach Klima, da bei heissen Bedingungen insgesamt mehr Wasser verdampft. Der Zustand der Atmosphäre wiederum bildet sich über Niederschläge im Polareis ab, und deshalb können Eisbohrkerne viel über das Klima der Vergangenheit berichten. CanStockPhoto

Wählerische Enzyme
Für Lebewesen spielen biochemische Reaktionen, bei denen Enzyme chemische Verbindungen umwandeln, eine grosse Rolle. Die Enzyme funktionieren nach dem Schlüssel-Schloss-Prinzip. Ihr aktives Zentrum fungiert als „Schloss“, in das nur die chemische Verbindung mit der richtigen Form (also der richtige „Schlüssel“) passt und umgewandelt wird. Enzyme haben meist eine Präferenz für das leichteste und häufigste Isotop, zum Beispiel bei Verbindungen mit Sauerstoff, Kohlenstoff und Stickstoff. Die schwereren Isotope passen zwar auch, aber weniger gut, weshalb sie vom Enzym seltener umgewandelt werden. CanStockPhoto
Wählerische Enzyme
Für Lebewesen spielen biochemische Reaktionen, bei denen Enzyme chemische Verbindungen umwandeln, eine grosse Rolle. Die Enzyme funktionieren nach dem Schlüssel-Schloss-Prinzip. Ihr aktives Zentrum fungiert als „Schloss“, in das nur die chemische Verbindung mit der richtigen Form (also der richtige „Schlüssel“) passt und umgewandelt wird. Enzyme haben meist eine Präferenz für das leichteste und häufigste Isotop, zum Beispiel bei Verbindungen mit Sauerstoff, Kohlenstoff und Stickstoff. Die schwereren Isotope passen zwar auch, aber weniger gut, weshalb sie vom Enzym seltener umgewandelt werden. CanStockPhoto

Pflanzentypen herausfinden
Mit Hilfe stabiler Isotope können Stoffwechselarten von Lebewesen analysiert werden: Zum Beispiel können C4-Pflanzen, die an warme und trockene Bedingungen angepasst sind, von C3-Pflanzen unterschieden werden (warum, das erfährst du im nächsten Bild). Das hier abgebildete Zuckerrohr ist eine C4-Pflanze. CanStockPhoto
Pflanzentypen herausfinden
Mit Hilfe stabiler Isotope können Stoffwechselarten von Lebewesen analysiert werden: Zum Beispiel können C4-Pflanzen, die an warme und trockene Bedingungen angepasst sind, von C3-Pflanzen unterschieden werden (warum, das erfährst du im nächsten Bild). Das hier abgebildete Zuckerrohr ist eine C4-Pflanze. CanStockPhoto

Pflanzentypen herausfinden (2)
Zuckerrüben sind C3-Pflanzen. Sie arbeiten bei der Photosynthese mit anderen Enzymen als C4-Pflanzen, um aus dem CO2 der Luft organische Verbindungen herzustellen. C4-Pflanzen verwenden dabei öfter das schwerere Kohlenstoffisotop 13C (6 Protonen, 7 Neutronen). Daher enthält Pflanzenmaterial von C4-Pflanzen einen höheren Anteil schwerer Kohlenstoff-Isotope als dasjenige von C3-Pflanzen. CanStockPhoto
Pflanzentypen herausfinden (2)
Zuckerrüben sind C3-Pflanzen. Sie arbeiten bei der Photosynthese mit anderen Enzymen als C4-Pflanzen, um aus dem CO2 der Luft organische Verbindungen herzustellen. C4-Pflanzen verwenden dabei öfter das schwerere Kohlenstoffisotop 13C (6 Protonen, 7 Neutronen). Daher enthält Pflanzenmaterial von C4-Pflanzen einen höheren Anteil schwerer Kohlenstoff-Isotope als dasjenige von C3-Pflanzen. CanStockPhoto

Pflanzenreste für die Klimaforschung
Stabile Isotope werden auf verschiedenen Wegen dafür genutzt, das Klima der Vergangenheit zu erforschen. Ausser Eisbohrkernen dienen dazu auch Pflanzenreste bzw. organische Verbindungen, die von Pflanzen produziert wurden und beispielsweise in Blättern eingelagert wurden. Dieses Pflanzenmaterial lagerte sich über Jahrtausende im Sediment von Seen ab und kann heute ausgegraben und untersucht werden. Ist die Pflanze zu einer Zeit gewachsen, als es besonders heiss und trocken war, enthält sie schwerere Isotope, als wenn sie unter kalten und nassen Bedingungen gewachsen ist. Wikimedia Commons
Pflanzenreste für die Klimaforschung
Stabile Isotope werden auf verschiedenen Wegen dafür genutzt, das Klima der Vergangenheit zu erforschen. Ausser Eisbohrkernen dienen dazu auch Pflanzenreste bzw. organische Verbindungen, die von Pflanzen produziert wurden und beispielsweise in Blättern eingelagert wurden. Dieses Pflanzenmaterial lagerte sich über Jahrtausende im Sediment von Seen ab und kann heute ausgegraben und untersucht werden. Ist die Pflanze zu einer Zeit gewachsen, als es besonders heiss und trocken war, enthält sie schwerere Isotope, als wenn sie unter kalten und nassen Bedingungen gewachsen ist. Wikimedia Commons

Lebensmittelbetrügern auf der Spur
Die verschiedenen Isotopenwerte von C4- und C3-Pflanzen können genutzt werden, um Betrüger zu entlarven, die bei Lebensmitteln falsche Inhaltsangaben machen, zum Beispiel beim Honig. Bienen ernähren sich von C3-Pflanzen, das heisst, auch ihr Honig enthält wie die Pflanzen einen hohen Anteil leichter Isotope. Manchmal wird Honig aber mit Zucker gestreckt, welcher vom Zuckerrohr, also von einer C4-Pflanze stammt. Daher enthält gestreckter Honig einen höheren Anteil schwerer Isotope als reiner Honig. CanStockPhoto
Lebensmittelbetrügern auf der Spur
Die verschiedenen Isotopenwerte von C4- und C3-Pflanzen können genutzt werden, um Betrüger zu entlarven, die bei Lebensmitteln falsche Inhaltsangaben machen, zum Beispiel beim Honig. Bienen ernähren sich von C3-Pflanzen, das heisst, auch ihr Honig enthält wie die Pflanzen einen hohen Anteil leichter Isotope. Manchmal wird Honig aber mit Zucker gestreckt, welcher vom Zuckerrohr, also von einer C4-Pflanze stammt. Daher enthält gestreckter Honig einen höheren Anteil schwerer Isotope als reiner Honig. CanStockPhoto

Die Entstehung von Gesteinen
Indem Forscherinnen und Forscher Gesteine auf ihre Isotope analysieren, können sie herausfinden, wie das Gestein entstanden ist. Zum Beispiel helfen stabile Isotope des Eisens, Sauerstoffs und Kohlenstoffs zu verstehen, wie „Bändereisenerze“ entstanden sind. Für ihre Entstehung im damaligen Ozean sind sowohl chemische als auch biologische Prozesse wichtig. Diese Gesteine sind 1.8 bis 3.8 Milliarden alt und unter anderem in Südafrika, Nordamerika und Australien zu sehen. James St. John/Wikimedia Commons, CC BY 2.0
Die Entstehung von Gesteinen
Indem Forscherinnen und Forscher Gesteine auf ihre Isotope analysieren, können sie herausfinden, wie das Gestein entstanden ist. Zum Beispiel helfen stabile Isotope des Eisens, Sauerstoffs und Kohlenstoffs zu verstehen, wie „Bändereisenerze“ entstanden sind. Für ihre Entstehung im damaligen Ozean sind sowohl chemische als auch biologische Prozesse wichtig. Diese Gesteine sind 1.8 bis 3.8 Milliarden alt und unter anderem in Südafrika, Nordamerika und Australien zu sehen. James St. John/Wikimedia Commons, CC BY 2.0

Die Pendlerin aus der Bronzezeit
Durch die Analyse von stabilen Isotopen können in der Archäologie Wanderungen von Menschen ermittelt werden. Es wurden die Überreste einer jungen Frau analysiert, die in Dänemark vor rund 3400 Jahren bestattet wurde. Dafür wurden die Strontium-Isotope in ihrem Körper untersucht. Während ihr Zahnschmelz Auskunft über ihre frühe Kindheit gibt, sagen ihre Haare und Fingernägel etwas über ihr letztes Lebensjahr aus. Denn Strontium wird mit dem Wasser aufgenommen und verbleibt in sehr geringen Mengen im Körper. Je nach Region unterscheiden sich die aufgenommenen Strontium-Isotope. Die Forschenden haben so herausgefunden, dass das Mädchen von Egtved einst zwischen Dänemark und dem Schwarzwald hin und her reiste. Warum sie das tat, bleibt uns jedoch verborgen. Wikimedia Commons
Die Pendlerin aus der Bronzezeit
Durch die Analyse von stabilen Isotopen können in der Archäologie Wanderungen von Menschen ermittelt werden. Es wurden die Überreste einer jungen Frau analysiert, die in Dänemark vor rund 3400 Jahren bestattet wurde. Dafür wurden die Strontium-Isotope in ihrem Körper untersucht. Während ihr Zahnschmelz Auskunft über ihre frühe Kindheit gibt, sagen ihre Haare und Fingernägel etwas über ihr letztes Lebensjahr aus. Denn Strontium wird mit dem Wasser aufgenommen und verbleibt in sehr geringen Mengen im Körper. Je nach Region unterscheiden sich die aufgenommenen Strontium-Isotope. Die Forschenden haben so herausgefunden, dass das Mädchen von Egtved einst zwischen Dänemark und dem Schwarzwald hin und her reiste. Warum sie das tat, bleibt uns jedoch verborgen. Wikimedia Commons
Forensik – du bist, was du isst
Wird eine Leiche gefunden, die nicht identifiziert werden kann, hilft die Analyse von stabilen Isotopen in Haaren, Knochen oder Fingernägeln bei der Bestimmung von Herkunft und Essgewohnheiten der Person. Die Kohlenstoffisotope können Auskunft darüber geben, ob die Person viele Lebensmittel aus C4-Pflanzen wie Mais gegessen hat. In den USA zum Beispiel konsumiert man viel mehr Produkte aus Mais als in der Schweiz. Die Isotope des Stickstoffs sagen etwas darüber aus, ob die Person viel Fleisch oder mehr pflanzliche Lebensmittel gegessen hat. Schwefelisotope geben Auskunft über den Anteil an Fisch in der Nahrung. CanStockPhoto
Forensik – du bist, was du isst
Wird eine Leiche gefunden, die nicht identifiziert werden kann, hilft die Analyse von stabilen Isotopen in Haaren, Knochen oder Fingernägeln bei der Bestimmung von Herkunft und Essgewohnheiten der Person. Die Kohlenstoffisotope können Auskunft darüber geben, ob die Person viele Lebensmittel aus C4-Pflanzen wie Mais gegessen hat. In den USA zum Beispiel konsumiert man viel mehr Produkte aus Mais als in der Schweiz. Die Isotope des Stickstoffs sagen etwas darüber aus, ob die Person viel Fleisch oder mehr pflanzliche Lebensmittel gegessen hat. Schwefelisotope geben Auskunft über den Anteil an Fisch in der Nahrung. CanStockPhoto
Diagnostik in der Medizin
Verschiedene Stoffwechsel-Erkrankungen können mithilfe von stabilen Isotopen diagnostiziert werden, zum Beispiel der Mangel an Ornithin-Transcarbamylase, ein vererbter Enzymdefekt. Eine mögliche Diagnose funktioniert so: Die Patienten bekommen das Salz Ammoniumchlorid (NH4Cl) verabreicht. Der Stickstoff im Salz ist aber künstlich angereichert mit schweren 15N Isotopen. Im Körper wird das Salz in andere Stickstoffverbindungen umgewandelt, wie Urea. Durch Analysen des 15N im Blut kann man herausfinden, wie viel des Salzes umgewandelt wurde. Bei kranken Menschen funktionieren die Enzyme nicht richtig, was man an den Ergebnissen erkennen kann. CanStockPhoto
Diagnostik in der Medizin
Verschiedene Stoffwechsel-Erkrankungen können mithilfe von stabilen Isotopen diagnostiziert werden, zum Beispiel der Mangel an Ornithin-Transcarbamylase, ein vererbter Enzymdefekt. Eine mögliche Diagnose funktioniert so: Die Patienten bekommen das Salz Ammoniumchlorid (NH4Cl) verabreicht. Der Stickstoff im Salz ist aber künstlich angereichert mit schweren 15N Isotopen. Im Körper wird das Salz in andere Stickstoffverbindungen umgewandelt, wie Urea. Durch Analysen des 15N im Blut kann man herausfinden, wie viel des Salzes umgewandelt wurde. Bei kranken Menschen funktionieren die Enzyme nicht richtig, was man an den Ergebnissen erkennen kann. CanStockPhoto